LC-MS là gì?
LC-MS là một kỹ thuật phân tích liên quan đến việc phân tách vật lý các hợp chất mục tiêu (hoặc chất phân tích) sau đó là phát hiện dựa trên khối lượng của chúng. Mặc dù tương đối mới, nhưng độ nhạy, tính chọn lọc và độ chính xác của phương pháp này đã khiến nó trở thành một kỹ thuật được lựa chọn để phát hiện số lượng microgam hoặc thậm chí nanogam của nhiều loại chất phân tích khác nhau, từ các chất chuyển hóa thuốc, thuốc trừ sâu và tạp chất thực phẩm, đến chiết xuất sản phẩm tự nhiên.
LC-MS hoạt động như thế nào?
Tách LC (LC Separation).
LC giúp phân tách vật lý của các chất phân tích trong mẫu chất lỏng hoặc dung dịch của mẫu rắn. Một vài microlit dung dịch mẫu được bơm vào dòng dung môi đang chảy, được gọi là pha động. Mặc dù thể tích tiêm tối ưu phụ thuộc vào các điều kiện thí nghiệm, nhưng có thể tiêm chính xác từ 0,1 µL đến 100 µL mẫu bằng cách sử dụng bộ lấy mẫu tự động.Pha động được bơm liên tục qua một cột (một cột không gỉ -ống thép) thường chứa đầy các hạt silica được phủ một chất lỏng khác, pha tĩnh. Khi hỗn hợp dung dịch mẫu-pha động đến cột, các thành phần của nó sẽ tương tác khác nhau với pha tĩnh (còn lại trong cột) tùy thuộc vào thành phần hóa học hoặc tính chất vật lý của chúng. Dựa trên cơ chế tương tác giữa chất phân tích và pha tĩnh, quá trình phân tách LC được phân thành các chế độ khác nhau, chẳng hạn như:
- Sắc ký phân vùng (Partition chromatography) – dựa trên sự khác nhau về độ hòa tan và tính kỵ nước của chất phân tích trong pha tĩnh so với pha động.
- Sắc ký trao đổi ion (Ion-exchange chromatography) – tách các chất phân tích trên cơ sở điện tích ion của chúng.
- Sắc ký loại trừ kích thước (Size-exclusion chromatography) – khai thác sự khác biệt về kích thước của các phân tử chất phân tích để tách chúng ra.
- Sắc ký ái lực (Affinity chromatography) – tách các chất phân tích dựa trên khả năng liên kết của chúng với pha tĩnh.
Một số chất phân tích sẽ tương tác mạnh hơn với pha tĩnh so với những chất khác, dẫn đến sự phân tách của chúng khi chúng đi qua cột. Các chất phân tích có tương tác ít nhất với pha tĩnh sẽ ra khỏi cột trước. Khi pha động tiếp tục chảy qua cột, các chất phân tích còn lại được loại bỏ tuần tự, những chất có tương tác mạnh nhất xuất hiện sau cùng. Thời gian một chất phân tích cụ thể ở trong cột là đặc trưng của chất phân tích đó và được gọi là thời gian lưu của nó (RT).
Đầu dò LC (LC detection)
Pha động chảy ra khỏi cột (chất rửa giải) đi qua một máy dò “phản ứng” với một tính chất vật lý hoặc hóa học nhất định, chẳng hạn như chỉ số khúc xạ hoặc độ hấp thụ ánh sáng, của chất phân tích bên trong nó. Phản hồi này được ghi lại dưới dạng một tín hiệu hoặc một “cực đại” gọi là “Peak” có cường độ (diện tích cực đại hoặc chiều cao cực đại) tương ứng với lượng thành phần có trong mẫu. Thời gian mà máy dò “nhìn thấy” chất phân tích là RT của nó. Có thể định danh hợp chất trong mẫu bằng cách so sánh RT của nó với RT của hợp chất đã biết. Mặc dù đây không phải là một phương pháp chính xác để nhận dạng hợp chất, nhưng đây là phương pháp hữu ích khi một số thông tin về mẫu đã được biết trước.
Khi các ion chất phân tích được tạo ra ở áp suất khí quyển trong giao diện, quá trình này được gọi là quá trình ion hóa áp suất khí quyển (API) và giao diện được gọi là nguồn API. Quá trình ion hóa phun tia điện (ESI) và ion hóa hóa học ở áp suất khí quyển (APCI) là những nguồn được sử dụng phổ biến nhất trong phân tích LC-MS.
Các ion chất phân tích được hút vào khối phổ kế nơi chúng chịu tác động của điện trường và/hoặc từ trường. Đường bay của các ion được thay đổi bằng cách thay đổi các trường ứng dụng để đảm bảo sự tách biệt của chúng với nhau trên cơ sở các giá trị khối lượng trên điện tích (m/z) của chúng. Sau khi phân tách, các ion có thể được thu thập và phát hiện bằng nhiều loại đầu dò khối lượng,2 trong số đó loại phổ biến nhất là hệ số nhân điện tử (the electron-multiplier). Khi các ion bị tách ra đập vào bề mặt của bộ nhân điện tử (một dynode), các điện tử thứ cấp được giải phóng. Các electron thứ cấp này được nhân lên bằng cách xếp tầng chúng thông qua một loạt các dynode. Dòng điện khuếch đại được tạo ra bởi dòng điện tử thứ cấp được đo và tương quan với nồng độ ion trong khối phổ kế tại bất kỳ thời điểm nhất định nào (Hình 1).
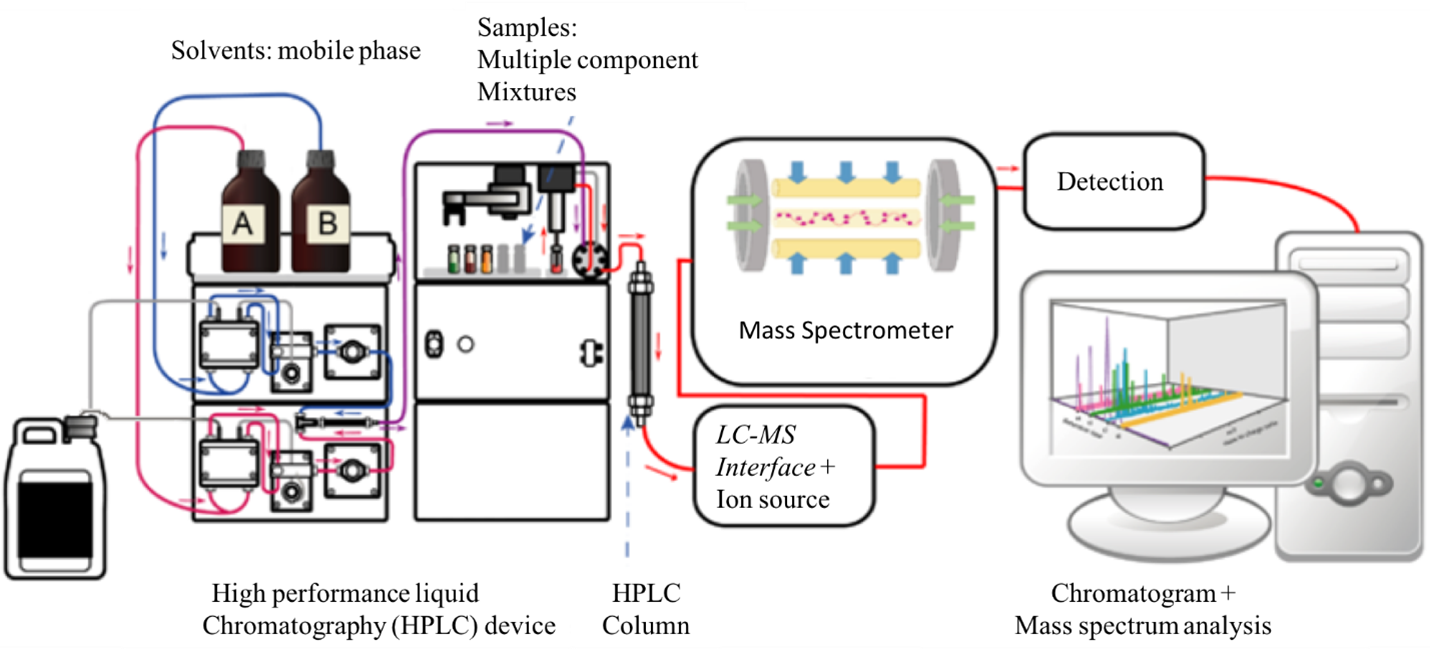
Hình 1: Sơ đồ ví dụ về thiết lập LC-MS
Vẽ biểu đồ dữ liệu LC-MS (Plotting LC-MS data)
Độ phong phú của các ion đo được trong quá trình phân tích mẫu bằng LC-MS được vẽ dưới dạng sắc ký đồ ion tổng (TIC). Biểu đồ này hiển thị cường độ cực đại của các ion chất phân tích so với RT của chúng. Hơn nữa, mỗi điểm trong sắc ký đồ được liên kết với một khối phổ. Phổ khối mô tả sự phong phú của ion so với các giá trị m/z đo được (Hình 2).
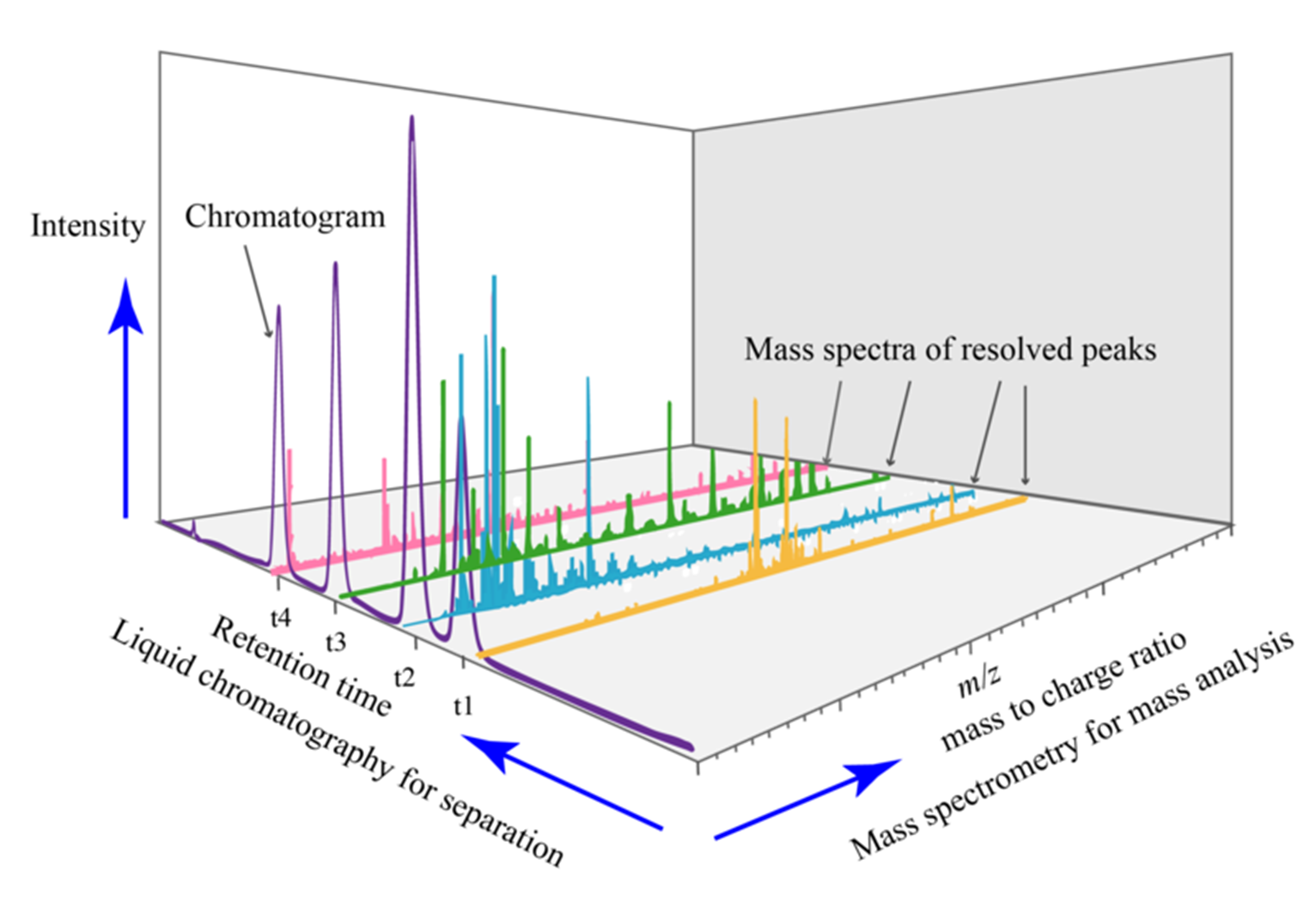
Hình 2: Biểu đồ đầu ra ví dụ từ phân tích LC-MS.
Khối phổ của một hợp chất không chỉ cung cấp thông tin về khối lượng của hợp chất gốc (từ giá trị m/z của ion của nó), mà còn giúp làm sáng tỏ cấu trúc của hợp chất từ sự phong phú tương đối của các đỉnh khối lượng đồng vị. Diện tích của pic chất phân tích được sử dụng để định lượng.
Khối phổ kế có thể được vận hành ở hai chế độ, a) quét và b) theo dõi ion được chọn (SIM). Ở chế độ quét, nó được đặt để phát hiện tất cả các ion từ giá trị m/z thấp đến giá trị m/z cao trong một khoảng thời gian xác định. Chế độ này được sử dụng khi phân tích các mẫu chưa biết hoặc khi không có sẵn thông tin về các ion có trong mẫu. Khi hoạt động ở chế độ SIM, khối phổ kế được đặt để đo các giá trị m/z cụ thể. Đây là chế độ hoạt động ưa thích để định lượng chính xác các hợp chất đã biết trong một mẫu.
Kết hợp sắc ký lỏng với khối phổ kế song song (Combining liquid chromatography with tandem mass spectrometry) (LC-MS/MS)
Có thể đạt được những cải tiến hơn nữa trong việc định danh mẫu và định lượng chính xác bằng cách kết hợp hai máy phân tích khối lượng vận hành nối tiếp. Máy quang phổ khối ba tứ cực (QQQ hoặc TQMS) và máy đo thời gian bay bốn cực (QTOF) là những máy quang phổ khối song song được sử dụng phổ biến nhất. Các cấu hình này cung cấp một số khả năng để phân tích mẫu.
TQMS bao gồm hai máy phân tích khối lượng tứ cực (Q1 và Q3) được phân tách bằng ô va chạm (q/Q2). Trong khi Q1 và Q3 được vận hành như các máy phân tích khối lượng để quét trên một phạm vi khối lượng hoặc để theo dõi một ion có giá trị m/z cụ thể, tế bào va chạm được sử dụng để phân mảnh các ion tiền thân được phân lập trong Q1 bằng cách cho chúng va chạm năng lượng cao với một trung tính. khí, chẳng hạn như argon, heli hoặc nitơ. Có thể vận hành TQMS ở bốn chế độ khác nhau (Hình 3), cụ thể là:
- Quét ion tiền chất (Precursor ion scan)– tứ cực đầu tiên (Q1) được quét trên một phạm vi khối lượng để chọn tiền chất của một ion sản phẩm cụ thể (giá trị m/z), sau đó được theo dõi trong tứ cực cuối cùng (Q3).
- Quét ion sản phẩm (Product ion scan) – Q1 được đặt để chỉ truyền tiền chất được xác định trước (m/z) đến ô va chạm, trong khi Q3 được quét trên một phạm vi khối lượng để xác định các mảnh thu được trong điều kiện thí nghiệm.
- Mất trung tính (Neutral loss (NL) – cả Q1 và Q3 đều được quét để xác định tất cả các tiền chất tạo ra sản phẩm do mất cùng một loại trung tính (không tích điện) từ tất cả các tiền chất. Phạm vi quét của Q3 được bù đắp bởi giá trị NL.
- Giám sát phản ứng được chọn(Selected reaction monitoring) (SRM) – cả Q1 và Q3 đều được thiết lập để giám sát các giá trị m/z cụ thể đối với các ion tiền chất và sản phẩm. Chế độ này được ưa thích để định lượng hợp chất do tính đặc hiệu và độ nhạy của nó. TQMS có thể được vận hành để theo dõi nhiều quá trình chuyển đổi tiền chất thành sản phẩm của cùng một chất phân tích cũng như các chất phân tích khác nhau.
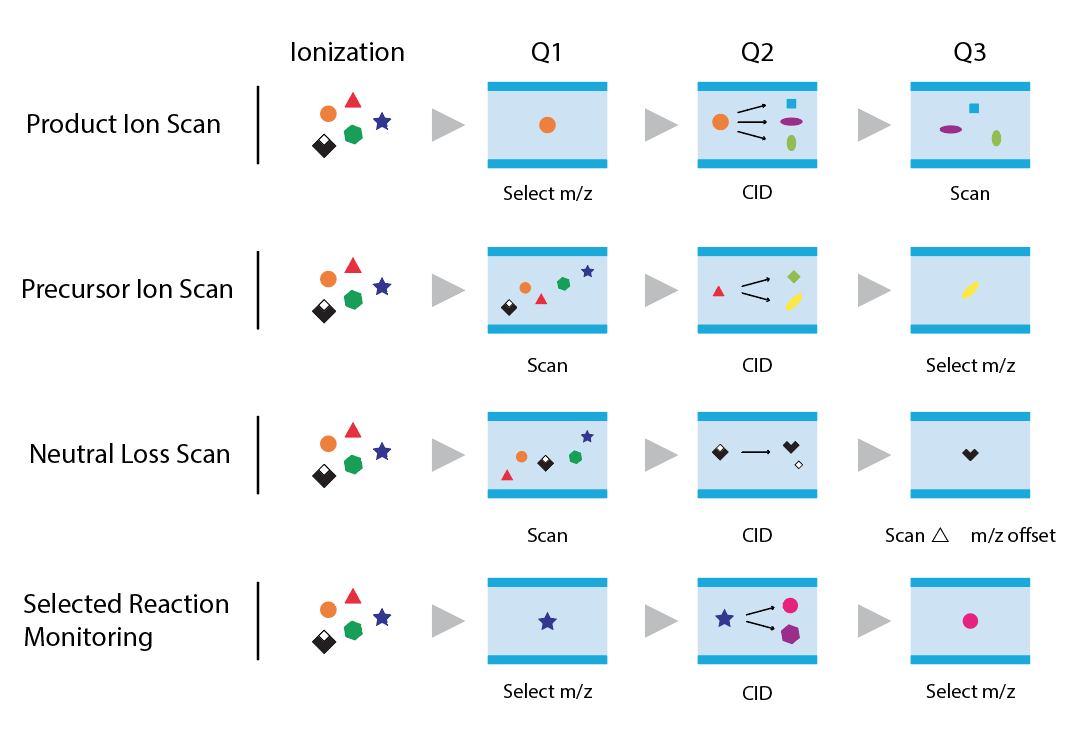
Hình 3: Các phương thức hoạt động của TQMS
Sự phân mảnh phụ thuộc vào cấu trúc của phân tử và các điều kiện thí nghiệm, chẳng hạn như áp suất khí và năng lượng va chạm. Do đó, trong một điều kiện phản ứng cụ thể, mẫu phân mảnh được sử dụng cùng với RT hợp chất và giá trị khối lượng chính xác của nó để định danh. Ngoài ra, việc theo dõi các ion phân mảnh cụ thể giúp cải thiện độ nhạy của phát hiện và do đó cho phép định lượng lượng hợp chất mục tiêu nhỏ hơn.
Máy quang phổ khối QTOF có một máy phân tích khối lượng bốn cực và một máy phân tích khối lượng thời gian bay được ngăn cách bởi một tế bào va chạm. Bộ tứ cực có thể được sử dụng để truyền các ion hoặc để cô lập một ion tiền thân cụ thể, ion này sau đó được phân mảnh trong tế bào va chạm. Trước tiên, một phần nhỏ của các ion được đưa vào máy phân tích TOF bằng bộ biến điệu và sau đó được tăng tốc vào vùng không có trường chân không cao bằng cách đặt điện áp cao. Các ion có giá trị m/z khác nhau di chuyển với vận tốc khác nhau trong ống bay và được tách ra khỏi nhau. Máy phân tích khối lượng TOF cung cấp độ phân giải khối lượng cao trong khi có thể quét nhanh chóng trên phạm vi khối lượng lớn.
Phân tích LC-MS (LC-MS analysis).
LC-MS đã được áp dụng rộng rãi để phân tích cả phân tử nhỏ và phân tử protein lớn trong các chất nền khác nhau. Một số ví dụ về các ứng dụng của công nghệ này là:
- định lượng tạp chất gây độc gen trong hoạt chất dược phẩm
- phát hiện mười hai hợp chất mô hình đại diện cho các loại chất kích thích cụ thể, chẳng hạn như chất đồng hóa và chất mô phỏng, trong hơi thở ra5
- định lượng các chất chuyển hóa của thuốc trong dịch sinh học
- phát hiện tạp chất trong nguyên liệu thực phẩm6 và thực phẩm bổ sung
- xác định alkylphenol ethoxylat (APEO) trong trầm tích xưởng thuộc da8- định lượng các sản phẩm chăm sóc cá nhân trong các mẫu nước hồ bơi và nước sông9
- định lượng nucleotide và các dẫn xuất của chúng trong tế bào vi khuẩn10
- định lượng hệ protein
- như một xét nghiệm nhanh để phát hiện SARS-CoV-211
Kỹ thuật này cũng đã được sử dụng trong phân tích nước uống, hóa dầu, đất, dược phẩm sinh học, thực phẩm và rượu vang, đồng thời phát hiện các chất per- và polyfluoroalkyl (PFAS) cũng như dư lượng thuốc trừ sâu.
Điểm mạnh và hạn chế của LC-MS
Điểm mạnh
LC-MS phù hợp để phân tích các hợp chất phân cực và không phân cực, cũng như các phân tử không bền nhiệt. Các hợp chất này có thể bao gồm từ các chất phân tích có khối lượng phân tử thấp với giá trị m/z < 1000 Da, đến các protein có khối lượng phân tử rất cao với giá trị m/z > 100.000 Da. Quá trình “ion hóa mềm” của các hợp chất chủ yếu tạo ra ion phân tử và các pic đồng vị hữu ích trong việc xác định khối lượng chính xác và công thức giả định của chất phân tích. Khi kết hợp với phổ phân mảnh, có thể làm sáng tỏ cấu trúc của chất phân tích.
Mặc dù, thông thường, một vài miligam hợp chất tinh khiết được yêu cầu để phân tích bằng LC-MS, chỉ cần 1 mg là đủ. Bằng cách vận hành MS ở chế độ SIM hoặc SRM, có thể đạt được giới hạn phát hiện trong khoảng ng/mL hoặc thậm chí pg/mL. Vì chỉ các ion cụ thể được theo dõi trong chế độ SRM, nên tính chọn lọc đạt được ngay cả đối với các chất phân tích có trong các nền phức tạp.
Hạn chế
Các thiết bị LC-MS đắt tiền để sở hữu, vận hành và bảo trì. Chuyên môn là cần thiết để chạy các công cụ và phân tích dữ liệu. Thông lượng mẫu vừa phải so với các kỹ thuật phân tích khác. Do phổ thu được phụ thuộc vào các điều kiện thí nghiệm, bao gồm cả loại thiết bị, phạm vi nhận dạng hợp chất thông qua so sánh với phổ tham chiếu bị hạn chế. Vì khối phổ kế là một máy dò phá hủy, nên phải cẩn thận khi xử lý các mẫu có thể không có sẵn hoặc không thể lấy được với số lượng lớn. Là một kỹ thuật dựa trên phòng thí nghiệm chứ không phải tại hiện trường, việc phân tích các mẫu không ổn định hoặc có phản ứng bằng LC-MS có thể là một thách thức.
Vì chỉ có thể bơm các mẫu chất lỏng vào cột, nên các mẫu rắn phải được hòa tan trong dung môi thích hợp hoặc chất phân tích phải được chiết xuất khỏi mẫu. Chuẩn bị mẫu bằng các kỹ thuật như chiết lỏng-lỏng (LLE) hoặc chiết pha rắn (SPE) là cần thiết để chiết các chất phân tích mục tiêu từ các mẫu phức tạp như huyết tương, thực phẩm và đất.12 Điều này không chỉ giúp cải thiện độ nhạy phân tích, mà còn làm giảm sự nhiễm bẩn (thảo luận trong phần tiếp theo) của hệ thống.
Nhưng vấn đề thường gặp của LC-MS (Common problems with LC-MS)
Mặc dù LC-MS mang lại một số lợi thế cho phân tích vết trong các nền phức tạp, nhưng cần phải thực hiện một số biện pháp phòng ngừa để vượt qua những thách thức sau khi sử dụng kỹ thuật này:
Nhiễm mẫu.
Độ nhạy, độ chọn lọc, khả năng tái tạo và độ phân giải của phép phân tích bị ảnh hưởng bởi các chất gây ô nhiễm, chẳng hạn như các ion kim loại, phthalate, polyetylen glycol (PEG), chất chống trượt, nước và các hạt xâm nhập vào hệ thống từ nhiều nguồn khác nhau như:
- thuốc thử và dung môi
- nước dùng để chuẩn bị dung dịch đệm
- hóa chất rò rỉ từ đồ thủy tinh
- ống vi ly tâm
- bộ lọc đầu vào
- dòng dung môi
- các bộ phận dụng cụ, chẳng hạn như phớt máy bơm
- khí được sử dụng để khử chất rửa giải trong nguồn và trong tế bào va chạm
- bản thân mẫu
Các chất gây ô nhiễm có thể cản trở việc phân tích bằng cách:
- ức chế hoặc tăng cường ion hóa (các) chất phân tích trong nguồn
- tạo cộng với chất phân tích
- che khuất các pic của chất phân tích và/hoặc xuất hiện dưới dạng các pic ma trong sắc ký đồ
- làm cho đường cơ sở ồn ào
- tắc hệ thống và cột, yêu cầu bảo trì thường xuyên và thay thế các bộ phận
Để giảm thiểu ô nhiễm:
- Nên sử dụng dung môi, nước và thuốc thử có độ tinh khiết cao để chuẩn bị pha động.
- Pha động mới chuẩn bị phải được sử dụng để giảm thiểu khả năng nhiễm vi sinh vật vào pha động nước và trùng hợp acetonitril (ACN).
- Nên tránh sử dụng xà phòng hoặc chất tẩy rửa để làm sạch dụng cụ thủy tinh vì chúng khó tẩy rửa và có thể gây cản trở trong quá trình phân tích.
- Phải sử dụng khí có độ tinh khiết cao (ví dụ: khí nitơ thường được sử dụng có độ tinh khiết > 95%).
- Máy tạo khí nitơ phải được bảo dưỡng tốt và phải thay bình khí khi áp suất giảm xuống dưới mức cho phép.
- Chất phân tích phải được chiết ra khỏi nền mẫu và các thông số sắc ký được tối ưu hóa để cải thiện độ phân giải của các pic chất phân tích từ các pic cản trở.
Hiệu ứng ma trận
Khi phân tích các mẫu sinh học, các thành phần mẫu khác có thể ngăn chặn hoặc tăng cường quá trình ion hóa của chất phân tích trong nguồn. Để giảm thiểu tác động của chất nền, các chất phân tích cần được phân lập khỏi chất nền. Do đó, chuẩn bị mẫu là điều kiện tiên quyết quan trọng của phân tích LC-MS. Mặc dù điều này làm giảm hiệu ứng nền, nhưng có thể khó trích xuất chỉ (các) chất phân tích từ nền. Để ngăn cản sự đồng rửa giải của các hợp chất cản trở, các thông số sắc ký cũng có thể được tối ưu hóa. Việc chuẩn bị các dung dịch chuẩn trong chất nền không có chất phân tích (sự phù hợp của chất nền) cũng giúp tính đến các hiệu ứng của chất nền. Nồng độ đã biết của các chất chuẩn nội được đánh dấu đồng vị, trải qua quá trình ức chế hoặc tăng cường ion hóa tương tự, được sử dụng để bù cho các hiệu ứng nền.
Chuyển giao (Carryover)
Các pic của chất phân tích có thể xuất hiện trong các lần tiêm mẫu trắng chạy sau mẫu có nồng độ cao do quá trình chuyển mẫu. Điều này phải được giải quyết bằng cách sử dụng các quy trình làm sạch, chẳng hạn như tiêm lặp lại mẫu trắng, rửa kim và điều hòa cột, để đảm bảo duy trì độ nhạy của phép phân tích.
Mất mẫu
Các chất phân tích, chẳng hạn như protein và DNA, có thể bị mất do liên kết không đặc hiệu với vật tư tiêu hao trong phòng thí nghiệm, chẳng hạn như bề mặt bên trong của các ống vi ly tâm. Sự hấp phụ của các chất phân tích ảnh hưởng đến độ chính xác và độ chính xác của xét nghiệm. Có thể giảm thiểu sự thất thoát chất phân tích bằng cách sử dụng các vật chứa có độ bám dính bề mặt thấp. Một cách tiếp cận khác là thêm các chất chặn để giảm thiểu sự tương tác của chất phân tích với bề mặt bên trong của vật chứa.
Lựa chọn đệm pha động
Vì chất rửa giải cột phải được loại bỏ trước khi phân tích MS, chỉ các chất đệm dễ bay hơi, chẳng hạn như amoni formate hoặc amoni axetat sẽ không kết tủa trong nguồn, mới có thể được sử dụng để chuẩn bị các pha động.
Bảo trì
Việc bảo trì thường xuyên khối phổ kế phải được thực hiện theo lịch trình đã xác định trước để đảm bảo độ chính xác, khả năng tái sản xuất và hoạt động không gặp sự cố của thiết bị cũng như giảm thiểu thời gian ngừng hoạt động ngoài kế hoạch.
Tài liệu tham chiếu:
- Dolan JW, Snyder LR. (1989) Injectors and autosamplers. In: Troubleshooting LC Systems. Humana Press, Totowa, NJ. doi:10.1007/978-1-59259-640-9_102. Medhe S. Mass spectrometry: Detectors review. Chem. Biomol. Eng. (2018); 3(4):51–58. doi:10.11648/j.cbe.20180304.11
3. Markgraf DF, Al-Hasani H, Lehr S. Lipidomics—Reshaping the analysis and perception of Type 2 diabetes. Int. J. Mol. Sci. 2016;17(11):1841. doi: 10.3390/ijms17111841
4. Chidella K, Dasari VB, and Anireddy J. Simultaneous and trace level quantification of five potential genotoxic impurities in ranolazine active pharmaceutical ingredient using LC-MS/MS. Am. J. Analyt. Chem, 2021;12:1–14. doi: 10.4236/ajac.2021.121001
5. Thevis M, Krug O, Geyer H, Schänzer W. Expanding analytical options in sports drug testing: Mass spectrometric detection of prohibited substances in exhaled breath. Rapid Commun. Mass Spectrom. 2017;31(15):1290–1296. doi: 10.1002/rcm.7903
6. Frank N, Bessaire T, Tarres A, Goyon A, Thierry Delatour. Development of a quantitative multi-compound method for the detection of 14 nitrogen-rich adulterants by LC-MS/MS in food materials, Food Addit. Contam: Part A. 2017;34(11):1842–1852. doi: 10.1080/19440049.2017.1372640
7. Dincel D, Olgan H, Canbaloğlu Z et al. Determination of dihydrocapsaicin adulteration in dietary supplements using LC-MS/MS. J. Chem. Metrol. 2020; 14(1):77–82. doi: 10.25135/jcm.36.20.01.1532
8. Mahalakshmi R, Pugazhendhi A, Brindhadevi K, Ramesh N. Analysis of Alkylphenol ethoxylates (APEOs) from tannery sediments using LC–MS and their environmental risks. Process Biochem. 2020;97:37–42, ISSN 1359–5113, doi: 10.1016/j.procbio.2020.06.015
9. Kharbouche L, Gil García MD, Lozano A, Hamaizi H, Martínez Galera M. Determination of personal care products in water using UHPLC–MS after solid phase extraction with mesoporous silica‐based MCM‐41 functionalized with cyanopropyl groups. J. Sep. Sci. 2020;43:2142–2153. doi: 10.1002/jssc.201901148
10. Zborníková E, Knejzlík Z, Hauryliuk V, Krásný L, Rejman D. Analysis of nucleotide pools in bacteria using HPLC-MS in HILIC mode. Talanta. 2019; 205.120161. doi: 10.1016/j.talanta.2019.120161
11. Schuster O, Zvi A, Rosen O, et al. Specific and rapid SARS-CoV-2 identification based on LC-MS/MS analysis. ACS Omega 2021;6 (5):3525–3534. doi: 10.1021/acsomega.0c04691
12. Jickells S. (2021). Sample preparation. In Analytical Techniques in Forensic Science (eds R. Wolstenholme, S. Jickells and S. Forbes). https://doi.org/10.1002/9781119373421.ch4
13. Grebe SK, Singh RJ. LC-MS/MS in the clinical laboratory – Where to from here?. Clin. Biochem. Rev. 2011;32(1):5–31. PMID: 21451775
14. Silvester S, Zang F. Overcoming non-specific adsorption issues for AZD9164 in human urine samples: Consideration of bioanalytical and metabolite identification procedures, J. Chromatog. B, 2012;893–894:134–143. doi: 10.1016/j.jchromb.2012.03.004.
Quý khách có nhu cầu tư vấn, vui lòng liên hệ:
| CÔNG TY TNHH THƯƠNG MẠI – DỊCH VỤ – KỸ THUẬT VIỆT NGUYỄN | |
| Địa chỉ | VPHCM: số N36, đường số 11, P. Tân Thới Nhất, Q.12, Tp. Hồ Chí Minh VPĐN: Số 10 Lỗ Giáng 5, phường Hòa Xuân, quận Cẩm Lệ, Tp. Đà Nẵng VPHN: 138 Phúc Diễn, P. Xuân Phương, Q. Nam Từ Liêm, Tp. Hà Nội |
| Hotline | PHÒNG MARKETING – TRUYỀN THÔNG:
|
| info@vietnguyenco.vn | |
| Website | https://www.vietcalib.vn| https://vietnguyenco.vn |